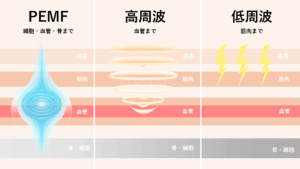
欧米では「PEMF(パルス電磁場)」という言葉が一般的になりつつあります。PEMFは、微弱な電磁波(パルス磁場)を体に照射して、細胞の電位バランスを整える技術。
血流促進や疲労回復、リラクゼーションなど、セルフケア分野で注目されている次世代ウェルネス機器です。ところが日本では、「PEMF機器」という言葉を耳にする機会はほとんどありません。
ネットを探しても、海外製の輸入品がいくつか見つかる程度で、国産メーカーがPEMFを開発・販売している例はほぼゼロです。なぜ日本では、この分野の製品が生まれないのでしょうか。
そこには、技術だけでなく「制度」「文化」「市場構造」といった複数の要因が複雑に絡み合っています。
PEMFとは何か ― 世界ではすでに確立された技術

PEMFとは Pulsed Electromagnetic Field の略で、直訳すると「パルス電磁場」。コイルなどから発生する弱い磁気を一定の周期で断続的に照射し、体内の細胞や組織を微弱に刺激する技術です。
この技術はすでに欧米では医療分野で研究が進み、骨癒合促進・疼痛緩和・組織修復などに応用されています。
米国ではFDA(食品医薬品局)が特定用途のPEMF機器を医療機器として承認しており、ドイツやスイスでも「血流改善」などの用途で広く使用されています。
世界の主要PEMF機器メーカー例
| 企業名 | 国 | 特徴 |
| Bemer Group | ドイツ | 医療認証を取得。血流サポート分野のパイオニア。 |
| MagnaWave | 米国 | 高出力PEMFを利用し、アスリート・獣医療にも導入。 |
| Pulse Centers | 米国 | 医療・クリニック・リハビリ市場に展開。 |
| OlyLife | シンガポール | PEMFとテラヘルツ波を融合させたハイブリッドセルフケア機器「P90」を開発。 |
こうした企業は、大学や医療機関と共同で臨床研究を行い、科学的データを蓄積。それを基盤に、医療機器・ウェルネス製品の両面で市場を拡大しています。
日本ではなぜPEMF機器が開発されていないのか

日本では、PEMFという技術を開発・製造する企業はほとんど存在しません。これは単に技術力の問題ではなく、制度面と文化面の壁が非常に大きいからです。
①医療機器認証の壁(PMDA承認)
画像参照:PMDA(医薬品医療機器総合機構)より
PEMFは「電磁波を体に照射する」という仕組み上、日本では医療機器扱いになる可能性が極めて高いです。
医療機器として販売するには、厚生労働省管轄の PMDA(医薬品医療機器総合機構) による認可が必要です。
この審査には、安全性・有効性の臨床データ提出が義務付けられており、承認まで3〜5年、開発費は数億円にのぼることもあります。
ベンチャー企業が参入できるほどの余裕はなく、国内メーカーはこの時点でほぼ撤退を余儀なくされます。
②国内研究の遅れと認知不足
欧米ではPEMFに関する論文が多数発表されており、NIH(米国国立衛生研究所)などが基礎研究を進めています。
一方で、日本では「低周波治療」や「磁気刺激(rTMS)」の研究は進んでいるものの、PEMF(低周波パルス磁場) そのものを専門的に研究する大学・機関は存在しません。
つまり、学術的な裏付けを国内で得られないため、企業も開発リスクを取れないのです。
- “Pulsed Electromagnetic Fields (PEMF)—Physiological Response”
(パルス電磁場(PEMF)―生理学的反応) - “Evaluation of Pulsed Electromagnetic Field Effects”
(パルス電磁場の影響の評価) - “Pulsed Electromagnetic Field Stimulation of Bone Healing and Joint Repair”
(パルス電磁場刺激による骨の治癒および関節修復の促進)
上記の研究の多くは「PEMF」そのものが主題というより、「パルス磁場」「超低周波磁場」の影響を探るものです。
日本では、PEMF機器の臨床試験・医療用途での承認取得レベルの研究(大規模RCTなど)はあまり多くない印象です。
製品化・医療機器化に直結するような「PEMFマット・家庭用機器に関する大規模データ」という点では、海外の方が先行しています。
法制度の違い ― 欧米と日本の決定的な差

日本の薬機法(旧薬事法)は、「医療機器」か「一般家電」かの二択しか認めていません。
その中間にあたる“ウェルネス機器”や“予防・セルフケア機器”というカテゴリが存在しないため、PEMFのような「医療でも家電でもない」製品が法的に定義できないのです。
アメリカ:FDAによる柔軟な区分け
アメリカでは、FDA(食品医薬品局)が「医療機器」と「ウェルネスデバイス」を分離しています。
- 医療目的(治療・疾患回復) → 医療機器(Class IIなど)として承認が必要
- 健康維持・セルフケア目的 → “General Wellness Device” として自由に販売可能
このため、OlyLifeやMagnaWaveのような企業は「医療目的」ではなく「ウェルビーイング向け機器」として登録し、
広告表現にも柔軟性を持たせています。
“The FDA encourages the development of general wellness products such as fitness trackers, which can empower individuals to take a more active role in managing their health.”
「FDA(米国食品医薬品局)は、フィットネストラッカーなどの“一般ウェルネス製品”の開発を奨励しており、これらは人々が自分の健康管理により積極的に関わることを可能にするものだと考えている。」
出典:FDA公式ガイダンスPDF(General Wellness: Policy for Low Risk Devices)
“The FDA’s final guidance states that the agency does not plan to regulate ‘general wellness products’ … provided they present a low risk to the safety of users and other persons.”
「FDAの最終ガイダンスによれば、“一般ウェルネス製品”については、利用者や他者の安全に対するリスクが低い場合、医療機器として規制する予定はないと明言している。」
出典:Ropes & Gray LLP 法務レポート(FDA Issues Final Guidance on General Wellness Products)
アメリカのFDAは、「病気の治療や診断」ではなく「健康維持・促進」を目的とする低リスク製品(例:PEMF機器やフィットネスデバイス)については、医療機器として規制しないという方針をとっています。
つまり、“健康サポート目的であれば、医療機器のような厳しい承認は不要” という柔軟な制度が整備されているのです。
ヨーロッパ:CEマーキング制度の存在
EUでは、CE認証を取得すれば加盟国全域で販売可能。PEMF機器の多くは「非侵襲」「低出力」カテゴリーに分類され、第三者認証機関(Notified Body) による技術審査で完結します。
臨床試験義務も比較的緩やかで、安全設計・電磁波強度・EMC試験などの工学的基準を満たせば販売が可能です
“Every medical device marketed in Europe must be compliant with the requirements of the MDR … Upon satisfactory certification … the manufacturer can affix the CE mark on the medical device and issue a EU Declaration of Conformity…”
「ヨーロッパで販売されるすべての医療機器は、MDR(医療機器規則)の要件を満たす必要があります。認証機関による審査で適合が確認されると、製造業者はその医療機器にCEマークを付け、EU適合宣言書を発行することができます。」
“The prerequisite for being able to legally market a medical device in Europe is a CE marking of the medical device. This is affixed by the manufacturer himself, provided he has proven that his product is safe and fulfills its medical purpose.”
「ヨーロッパで医療機器を合法的に販売するための前提条件は、その医療機器がCEマーキングを取得していることです。製造業者は、自社製品が安全であり、医療目的を果たすことを証明したうえで、自らCEマークを付けることができます。」
欧州では、医療機器を販売するためにCEマークの取得が義務です。ただし、アメリカFDAのような「中央集権的な承認」ではなく、第三者機関(Notified Body)による安全・性能評価を受ければ、メーカー自身がCEマークを付けて販売できるという点が特徴です。
つまり、欧州では「安全性を証明できれば中小企業でも市場に出られる」仕組みが整っており、
PEMFのような新しい健康機器も比較的スピーディーに流通可能となっています。
日本:医療機器か雑貨かの“極端な二分”
一方、日本ではPMDA(医薬品医療機器総合機構)の承認を得なければ、「健康効果」「体への作用」をうたうことができません。
そのため、メーカーは“温熱器具”や“マッサージ器”といった形でしか販売できず、PEMFのような新技術は法制度の空白地帯に取り残されています。
| 項目 | 欧米 | 日本 |
| 医療と健康の中間領域 | 存在(Wellness分類) | 存在しない |
| 臨床試験義務 | 効果によって柔軟 | 原則必須 |
| 表現の自由度 | 「効果を控えめに」ならOK | 「一切言ってはいけない」 |
| 開発コスト | 数千万〜1億円規模 | 数億円規模 |
| ベンチャー参入 | 可能 | ほぼ不可能 |
「この法律で『医療機器』とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(…)であって、政令で定めるものをいう。」
— 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)第2条第4項
「簡潔に言うと、私たちのからだの構造や機能に対して効果・効能をもつと承認されたものは医療機器、承認されていないものは雑貨とみなされます。」
引用:株式会社Officeファーマヘルスより
日本では、製品が「医療機器」として扱われるのか、それとも「一般雑貨/雑品・健康器具」として扱われるのか、その大きな分かれ目は、法律で定義された目的・機能に基づいています。
つまり「人または動物の疾病の診断・治療・予防に使用される」「身体の構造または機能に影響を及ぼす」ことが目的とされている機械器具等は、法律上「医療機器」に該当します。
一方で、その条件に該当せず、例えば「健康維持・美容目的」など機能が制限された雑貨的用途としての器具は、薬機法の“医療機器”の定義から外れるため、より軽い規制(雑品・健康器具扱い)となるケースがあります。
海外企業に見る成功例 ― OlyLifeの戦略

シンガポールのOlyLife社は、PEMFにテラヘルツ波を組み合わせたハイブリッド機器「P90」を開発。
医療機器としてではなく、「セルフケア・リラクゼーション製品」として展開しています。
同社は、CE・FCC・RoHSなど複数の国際安全認証を取得し、「健康サポート」「血流促進」「睡眠改善」などの穏やかな表現で販売。

これにより、医療認可を回避しつつ、法的にクリーンな状態で世界展開を実現しています。
日本でもOlyLife製品は、医療機器ではなく「セルフケア用品」として販売されており、まさに“制度の壁を理解した上でのグローバル戦略”と言えます。
PEMFは“日本未開の市場” ― だが未来は明るい
PEMFは、欧米ではすでに「科学とウェルネスの融合技術」として社会に浸透しています。
一方で、日本では法制度・研究・文化の壁により、企業が開発に踏み出せていないのが現状です。
しかし、OlyLifeのような海外企業が日本市場に参入したことで、「PEMFとは何か」「どう活用できるのか」という理解が少しずつ広がりつつあります。
これから日本が追いつくためには、技術よりもまず、“制度と認識”をアップデートすること。
PEMFはまだ未知の分野ですが、「体を電磁波で整える」という考え方が、セルフケアの新しい常識になる日も遠くないでしょう。






コメント